导读:
东方富海博士后创新实践基地秉承研究发现价值、研究引领投资的理念,对投资实务进行前瞻性研究。我们特别设立了“富海洞察”专栏,用于发布基地系列研究报告,供交流探讨。本文是基因治疗的相关研究,为基地出品的第十九篇报告。
基因治疗是指将外源正常基因导入靶细胞,纠正或补偿异常基因引起的疾病,达到治疗目的。自CRISPR基因编辑技术发明以来,基因治疗领域飞速发展,人类历史上第一款基因治疗药物也于2023年底正式上市。CRISPR基因编辑技术是21世纪生命科学领域最重要的技术革新之一,为生命科学研究、疾病治疗、医学检测等带来了革命性的进展。本文重点讨论CRISPR基因编辑的技术迭代,及其带动的基因治疗领域新进展,为投资提供理论依据。
2024年3月21日,世界上第一例基因编辑猪肾的人体移植成功实施。这颗猪肾经过了基因改造,减小了排异风险,成为能与人体兼容的肾脏。eGenesis公司使用CRISPR-Cas9技术,对猪的DNA进行了69次精确编辑,不但敲除了3种导致超急性免疫排斥的基因,还插入了7个调控免疫排斥信号通路的人类基因,用来预防人体对猪肾产生的免疫排斥反应;同时,也通过基因编辑让猪DNA中的内源性逆转录病毒失活,防止出现移植人体时产生病毒感染问题。
eGenesis公司之所以能完成多达69次的精准编辑,实现科幻片中的场景,离不开2012年诞生的CRISPR基因编辑技术。该技术,于2020年获得诺贝尔化学奖,在短短7年时间内,已经给生命科学学术研究、疾病治疗、医学检测等领域带来了革命性的改变。自2023年11月起,英国MHRA(药品和健康产品管理局,Medicines and Healthcare products Regulatory Agency)、美国FDA(食品和药物管理局,Food and Drug Administration)和欧盟EC(欧盟委员会,European Commission)先后批准了首款基于CRISPR的基因编辑疗法Casgevy上市,用于治疗镰状细胞性贫血(SCD)和输血依赖性β地中海贫血(TDT)。经过十余年的技术更迭,这把基因剪刀已经扩展成为丰富的碱基编辑工具箱,包括微型化CRISPR系统、BEs碱基编辑器、表观遗传编辑器等,让更多疾病有了被治愈的可能。
1基因组编辑的基本原理
CRISPR-Cas核酸酶可对目标基因DNA进行高效的切割与拼接,迅速成为基因编辑的主力军。目前应用较广泛的Cas酶主要有Cas9和Cas12家族,图1展示了以Cas9和Cas12为主的基因组编辑原理。
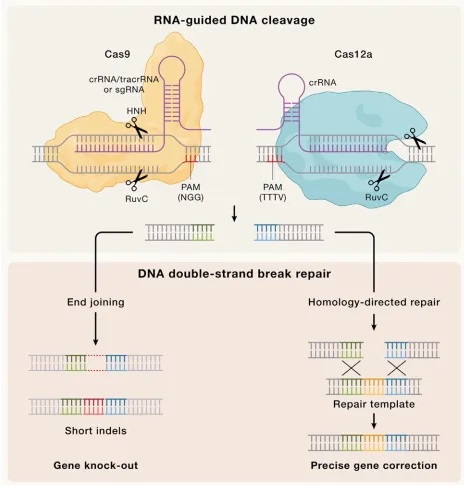
▲图1 CRISPR基因组编辑的原理机制
经典的Cas9蛋白来源于化脓性链球菌(SpCas9),是第一个用于基因组编辑的Cas核酸酶,因其天然的高活性和特异性,是目前应用最广泛的基因编辑器。Cas9由单向导RNA (sgRNA)或者双向导RNA引导至目标基因DNA序列旁, 双向导RNA即CRISPR RNA (crRNA)和反式激活CRISPR RNA (tracrRNA)。核酸酶正确识别目标DNA主要依靠PAM(protospacer adjacent motif ),它是与引导RNA互补配对的一小段碱基序列,位于DNA非靶链(NTS)的附近, Cas9主要识别NGG PAM。结合到目标DNA后,核酸酶催化DNA切割,产生DNA双链断裂(DSB)。由于切掉了一段DNA双链,细胞会通过胞内途径修复DSB损伤,修复过程中缺少模板DNA信息,会随机引入遗传突变(Indels),这个途径称为末端连接(End-joining pathways)途径。
Cas12a是起源于V型CRISPR-Cas系统的Cas核酸酶,在Cas9之后被发现,同样用于基因组编辑。与Cas9相反,Cas12a不需要tracrRNA激活,而是通过识别crRNA重复衍生片段中的保守假结构来催化剪切。Cas12a靶向含有5’端TTTV PAM (V = G, C或A)的DNA,并通过单一RuvC结构域催化位点,依次从PAM的远端切割DNA双链,产生一个5NT的缺失。PAM远端的DNA产生了DSB,并与酶分离,而Cas12a仍保持着催化活性,能够反式剪切额外的单链DNA (ssDNA)底物,Cas12a的反式核酸酶活性还可用于序列特异性的核酸检测。因此,Cas12a是一种高效的核酸酶,能够精确地编辑基因,也与Cas9在功能上形成互补。
传统的编辑方法需要在基因组中引入位点特异性双链DNA断裂,通过内源性细胞DNA修复途径将其修复。由Cas9或Cas12a酶产生的DSB通常通过末端连接途径(通常容易出错)或精确的同源定向修复(HDR)机制进行修复。末端连接是哺乳动物细胞中DNA修复的主要模式,它通过非同源末端连接(NHEJ),或微同源介导的末端连接(MMEJ)途径直接修复断裂的DNA末端。在修复前对裸露的DNA末端进行处理,引发核苷酸的添加或移除,导致DSB位点的短片段插入或缺失(统称为Indels),从而实现基因敲除或者缺失。
相反,HDR是一种精确的DSB修复途径,它依赖同源的DNA分子作为模板来指导修复。通过外源的人工同源修复模板,HDR可以在目标基因组范围内精确地引入所需的突变、插入或缺失。修复模板以双链DNA(通常通过质粒或病毒载体)或单链寡核苷酸(ssODNs)的形式组成,携带所需的突变,其两侧是与DSB同源的序列。虽然这种方法在原则上可以进行核苷酸的精准编辑,但HDR主要在分裂期的细胞中进行,它需要的修复因子只在S和G2期表达。因此,HDR的效率取决于修复模板的类型、递送方法、细胞类型、局部染色质背景以及其他可以影响DNA修复途径的因素。
2基因组编辑的主要难点及解决方案
CRISPR-Cas作为简单有效的基因编辑工具,推动了科学研究和产业化发展,为基因治疗奠定了坚实基础。然而,CRISPR基因组编辑面临着四个主要限制,包括脱靶效应、靶向范围、精准编辑及靶向递送。目前,对CRISPR编辑系统的改造主要围绕这四个方面展开。
1. 脱靶效应
链球菌中的天然CRISPR-Cas会在一定程度上容忍sgRNA和目标基因的不匹配,这可能是应对噬菌体高突变率的进化结果。但是,当CRISPR-Cas作为编辑工具应用于疾病治疗和生物技术时,这种不匹配会连带编辑基因组中的无关基因,造成不可预测的遗传风险,这种现象称为脱靶效应。
Cas9的脱靶效应主要出现在与目标基因序列相似的DNA中,脱靶的范围从单个碱基错配、多个连续碱基错配,到核苷酸片段的插入或缺失。当脱靶效应发生,基因组中多个位点的切割可能导致基因组重排,如缺失、倒位或染色体易位,并引发DNA损伤和应激反应。实际上,Cas9在DNA结合和切割中有特定的检查点,大多数的脱靶位点仅结合Cas9,不会导致dsDNA的切割和编辑。脱靶效应的湿实验表明,体内脱靶切割事件的频率远远小于体外,体内有某些机制可以保护基因组免受脱靶效应影响。
解决方案:
脱靶效应是基因治疗的一个主要问题,人们也正在努力开发更高效的方法来预测和检测脱靶活性。目前,人们已经找到高保真核酸酶变体、化学修饰的引导RNA和基因组编辑核酸酶来调控脱靶效应,并取得不俗的效果。
2. 靶向范围
CRISPR核酸酶与靶向DNA的结合位点需要在PAM序列附近。SpCas9是应用最广泛的基因编辑核酸酶,它的PAM是NGG,理论上平均每8个核苷酸就能找到一个合适的靶位,但由于一些基因的高A/T含量,SpCas9不能靶向这些基因。Cas12a核酸酶识别富含T的PAM序列,通常是TTTV PAM (V = G, C或a),但它的靶向范围同样受到限制。
解决方案:
为了克服由PAM带来的靶向限制,近年来已经开发了许多人工Cas9变体,可以修改或放宽PAM特异性。人工Cas9变体扩大了可靶向位点的范围,但同时也降低了靶向特异性,增加了脱靶效应。
3. 精准编辑
利用CRISPR核酸酶产生的DSB可显著提高哺乳动物的HDR发生率,从而达到精准编辑的目的。然而,HDR仅发生于分裂期的细胞中,也容易伴随发生NHEJ,造成基因编辑出错。基因编辑的精确度还受到其他因素的影响,例如伴随基因编辑发生的基因片段缺失、染色体重排,甚至染色体丢失等。因此,寻求新的途径控制编辑结果、提高编辑精准度是完善CRISPR核酸酶系统的重点工作。
解决方案:
首先,可以通过提高HDR效率促进精准编辑,挑选合适的DNA模版序列和增强模版的递送效率均可以显著提高HDR的效率。目前的方法是使用不对称的ssODN模版,引入沉默突变从而阻断靶位点的反复切割,或将修复供体模板系在断裂位点附近。其次,使用预先组装的Cas9-ri-核粒递送编辑元件,同时将细胞同步化,也可以增强HDR效率,细胞周期同步化可以通过小分子抑制剂实现。也可以通过其他方法,例如抑制关键的NHEJ因子减少NHEJ途径的发生,从而使细胞选择HDR途径;增加HDR中涉及的修复因子(如Rad51、Rad52或Mre11)表达率;在人原代T细胞中,设计工程化的ssDNA修复模板,形成Cas9-RNPs可识别的dsDNA末端,与小分子DNA修复调节剂联合使用,可以实现超过80%-90%的HDR编辑效率;利用次级引导RNA靶向NHEJ编辑副产物也可以提高HDR的效率。
尽管取得了这些进展,使用同源模板引入基因突变,特别是长片段仍然具有挑战性。一些终末分化的细胞,如神经元,HDR的发生率也不高。因此,使用基于DSB的策略进行精确编辑的应用范围还比较有限。这些限制也推动了不依赖于DSB的基因组编辑技术的发展,并消除了对HDR的需求。其中最具代表性的是碱基编辑器(base editor,BE)和先导编辑器(prime editor,PE),以及基于CRISPR的重组酶和转座酶。
4. 靶向递送
靶向递送系统是限制体内和体外编辑的关键因素,递送系统需要将CRISPR组件安全、特异、高效地送到靶细胞。在体内治疗中,CRISPR组件及其递送质粒的免疫原性也是影响递送效率的关键因素。已有数据表明,人类体内有Cas9抗体的预存免疫和对应的反应性T细胞,在犬类和非人灵长类动物疾病模型中,Cas9免疫会消减治疗效果。目前已经有几种策略克服预存免疫的问题,例如,通过工程化改造消除Cas9的免疫原性表位,调节免疫反应,以及限制Cas9表达的总时长。
解决方案:
Cas9/Cas12a编辑系统可以根据靶细胞或器官的类型选择不同的递送方式。对于大多数体外(即离体)培养细胞,电穿孔(核感染)或脂质体介导的递送效率很高,是最普遍的递送方式。Cas9和引导RNA可以RNA、质粒DNA或体外核糖核蛋白复合体(RNP)等形式递送。使用质粒长期表达Cas9复合物可能导致高脱靶率和质粒随机整合,瞬时RNA递送系统成为体外治疗中基因编辑的首选。例如,通过显微注射或电穿孔技术,将Cas9 RNPs或mRNA导入细胞中。
在哺乳动物中,CRISPR-Cas9的体内递送一般是通过病毒载体实现的。在腺病毒(AdV)、慢病毒(LV)、腺相关病毒(AAV)和病毒样颗粒(VLP)中,均可用基因编辑模块替换载体病毒中的病毒基因,达到减毒和递送的双重效果。因为AAV具有低免疫原性、高递送效率和细胞亲和性,AAV是体内递送的首选载体。但AAV相对较小,包装DNA的能力有限(约4.7kb),除非使用超紧凑启动子,否则很难将编码SpCas9 (4.2 kb)及其sgRNA (约100nt)的基因打包到单个AAV载体中。为了解开此限制,人们在寻找更小的Cas9同源酶和关注紧凑型的Cas12家族酶。
CRISPR组件也可以通过脂基纳米颗粒(LNPs)完成体内靶向递送。LNP的优点是安全性更高,免疫原性更低。LNPs通过内吞作用进入细胞,在此过程中LNP内容物可能逃离核内体,被转移到细胞核中,完成药物递送;或者LNP被溶酶体降解,形成无效递送。
3基因组编辑的发展方向
自CRISPR基因编辑出现以来,该领域以超乎想象的速度发展,上节提到的初代基因编辑系统的问题不断得到解决。本节重点讨论基因组编辑的重点发展方向,寻找基因编辑的技术生长点和最具有投资价值的细分赛道。
1. Cas9以外的核酸酶新家族:开发新功能,规避Cas9专利
Cas9作为初代基因组编辑核酸酶,活性好准确率高,发展至今仍然是主流碱基编辑工具。新核酸酶的开发思路是,寻找与Cas9功能类似但结构不同的替代型天然核酸酶,可以规避Cas9专利;或者通过天然筛选和工程化改造,补齐Cas9的短板,开发核酸酶的新功能。
经过全球开发者的努力,已经发现了十几种新型RNA引导的核酸酶。2015年,人们发现了Cas12a。Cas12与Cas9的性质差异很大,它有全新的PAM、引导RNA和切割模式,在体内表现出更高的特异性和更低的脱靶活性。在此之后,人们用生物信息学又发现了一系列具有不同PAM和引导RNA的Cas核酸酶。例如,紧凑型V型核酸酶,体量非常小,有望组装到大小有限的病毒载体(如AAV)中。近年,出现了更多新型的RNA靶向核酸酶,如Cas13、 Cas12a2和Cas12g,丰富了分子编辑工具箱,使人类不仅可以编辑DNA序列,也可以靶向编辑或降解mRNA,实现更精准的核酸检测等。
2. 碱基编辑器:定点的单基因编辑,不依赖模版DNA,脱靶率低
2016年,刘如谦团队开发了碱基编辑(Base Editing)技术,首次实现了对单个碱基的精准编辑,而且无需DNA双链断裂,并将该技术应用在Beam Therapeutics的多条管线中。国内外多家基因治疗公司也开发了碱基编辑器,比如,邦耀生物、辉大基因、正序生物、尧棠生物、贝斯昂科等公司都有其自主研发的碱基编辑器。目前该技术在科研层面取得了一定的发展,药物管线的应用仍在临床前阶段。
CRISPR碱基编辑器(BEs)可以在不需要DSB和同源修复模板的情况下编辑目标位点突变,从而在HDR缺陷细胞中编辑基因。BEs由RuvC失活的Cas9与核苷酸脱氨酶组成,目前有两大类BEs。胞嘧啶BEs (CBEs)含有胞苷脱氨酶(如APOBEC1)衍生的催化结构域和尿嘧啶糖基酶抑制剂(UGI)结构域,介导C到T的转化,该催化过程如图2所示。
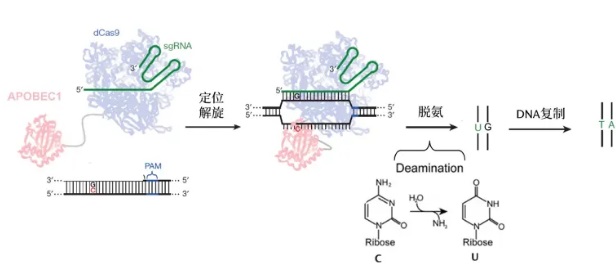
▲图2 BEs碱基编辑过程
腺嘌呤BEs (ABEs)拥有tRNA特异性脱氨酶TadA的腺苷脱氨酶结构域,介导A到G的转化。经过定向进化设计后,TadA主要作用于ssDNA。BEs结合Cas9模块后,在非靶DNA链的PAM远端的“编辑窗口”将胞嘧啶或腺嘌呤分别想象为尿嘧啶或肌苷。在DNA复制过程中,它们分别被读出为胸腺嘧啶和鸟嘌呤,从而诱导点突变。从BEs的发明到现在,CBE和ABE编辑器已经经过了多次迭代,活性提高了,脱胺酶引起的脱靶编辑减少了,碱基编辑库已扩展到A-to-C、A-to-Y和C-to-G的碱基转换。由于编辑效果精准可控,BEs已经广泛应用于全基因组敲除和突变筛选,特别适用于单点突变引起的疾病,达到治疗性校正的目的。但BEs也有一些局限,包括有限的效率、旁观者编辑、宽泛的编辑窗口和脱靶活性。尽管发生频率远远低于经典的Cas9基因编辑,ABEs和CBEs也会通过在靶位点产生DSB、缺失和易位导致无法预测的遗传毒性。这些问题可以通过一些方法调整优化,例如调整交付时间、编辑器的表达水平等。
3. 先导编辑器:单点和大片段修改,不依赖模版DNA
2019年,刘如谦团队开发了先导编辑(Prime Editing)技术,无需DNA双链断裂,不依赖DNA模板,可有效实现所有12种单碱基的自由转换,也可以有效实现大片段DNA的精准插入与删除。基于这项研究创立的基因编辑公司 Prime Medicine 已上市。
先导编辑器是基于Cas9发展而来的一种新型碱基编辑方法,可以产生指定位点的突变,也可以引入与HDR无关的碱基片段插入或者删除。如图3所示,先导编辑器由pegRNA (prime editing guide RNA,pegRNA)和融合蛋白组成,融合蛋白由Cas9内切酶、失活的HNH结构域和工程逆转录酶(RT)组成。pegRNA包含一个与目的基因的NTS互补的3’端延伸序列,该序列可以将目的突变点设计进去。Cas9在NTS序列中切出一个缺口,然后与pegRNA延伸片段进行碱基互补配对。通过RT催化引入突变位点,将NTS的3’端延伸,将pegRNA作为模板引入突变。
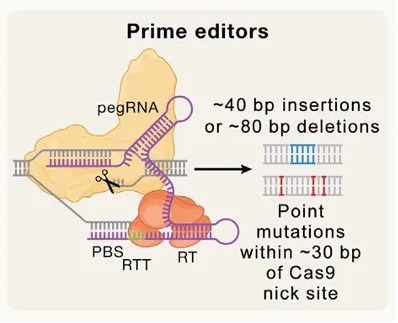
▲图3 先导编辑器
4. 表观遗传编辑:不改变DNA序列,可逆,不脱靶
2021年,刘如谦创立了表观遗传编辑公司 Chroma Medicine,开发基于CRISPR的表观遗传编辑技术。表观遗传学是研究DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA的科学,是指在不改变DNA序列的前提下调控染色体结构、基因活性和基因表达。表观遗传编辑可以在不改变遗传密码的情况下调控基因表达,使基因持久沉默或者多重激活。与向基因组中插入或删除基因的基因编辑公司相比,表观遗传编辑对脱靶性的担忧更少,这对于安全性和监管要求来说,是一个明显优势。国内首家布局该领域的企业是益杰立科,国外主要有Chroma Medicine、Tune Therapeutics、Epic Bio和Omega Therapeutics四家初创公司。
以Chroma Medicine为代表的公司建立了CRISPR off的表观基因组编辑方法,实现基因的表达沉默。如图4所示,CRISPR off系统通常会用到DNA甲基转移酶(如Dnmt3A或Dnmt3L),利用Cas9-sgRNA系统将DNA甲基化转移酶准确带到目的基因附近,将目的基因和相应的组蛋白甲基化,达到沉默表达的目的。这种沉默可以在CRISPR on系统的作用下逆转,CRISPR on系统通过去甲基化完成激活,将Cas9-sgRNA与DNA去甲基化酶TET1、转录激活域结合起来,通过去甲基化达到激活基因的目的。另一种思路是通过乙酰化沉默或激活基因表达,将Cas9-sgRNA与组蛋白乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDAC)组合起来,HATs和HDAC可以分别修饰染色质,从而激活或抑制基因表达。
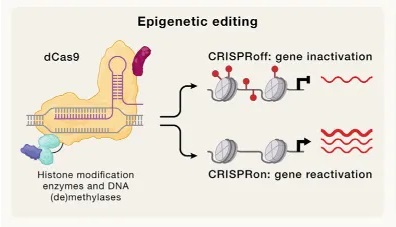
▲图4 表观遗传编辑器
5. RNA编辑器:更小,更便捷,更安全
RNA编辑的研究早在1995年就开始了,2018年,Joshua Rosenthal 通过使用ADAR指导RNA(guide RNA to ADAR)的RNA片段,让ADAR对互补RNA链上特定位点的碱基进行编辑。与DNA编辑造成的永久变化不同,RNA编辑的作用是可逆的,因为细胞会不断生成新的RNA拷贝。这套体系可以被用来重复治疗特定遗传疾病,同时不需要面对永久改变DNA编码而带来的长期未知风险。Joshua与Atlas合作创建了Korro Bio公司,开发基于RNA编辑的疗法。2017年,张锋博士开发出新的RNA编辑器,他的团队将ADAR的催化部分与一个Cas蛋白相结合,引导对特定RNA序列进行单碱基编辑,如图5所示。随后,他与David Liu等人联合创建了Beam Therapeutics公司。中国的辉大基因和博雅辑因也开发了RNA编辑系统。
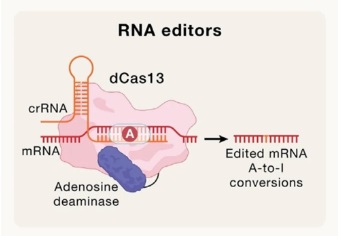
▲图5 RNA编辑器
将ADAR酶与Cas酶相结合开发的RNA编辑系统可能帮助ADAR酶更精准地与特定RNA序列相结合,从而减少RNA编辑的脱靶效应,这是RNA编辑器开发的一个方向。而产业界开发的另一个方向是不使用Cas酶,通过对指导RNA序列进行改造和优化,进一步精简RNA编辑系统,让它们更容易转化为临床疗法。只使用gRNA和人体自身的ADAR酶进行RNA编辑,不引入外源蛋白,可以避免CRISPR系统带来的潜在风险。因为Cas蛋白来自细菌,可能引发人体免疫系统的反应。化学合成的指导RNA与反义寡核苷酸相同,这是一类可以治疗大脑、眼科和肝脏疾病的药物形式。
2024年1月29日,美国生物技术公司 Ascidian Therapeutics 宣布旗下在研RNA外显子编辑疗法ACDN-01的IND申请获FDA批准,该候选药物还被授予快速通道资格。这是FDA首次批准RNA编辑疗法进入临床。
4基因编辑的商业化发展
商业化是推动技术发展的强大动力,CRISPR技术迅速发展,其巨大的商业潜力催生了一批公司。CRISPR技术的发明人Jennifer Doudna和Emmanuelle Charpentier创立了Caribou(驯鹿生物),CRISPR Therapeutics,Intellia,Scribe Therapeutics,Mammoth Biosciences等公司,涉及疾病诊断及治疗、新型碱基编辑工具和农业等。其中,CRISPR Therapeutics与Vertex Pharmaceuticals合作,共同开发了Casgevy,成为全球首款上市的基因治疗药物。该领域另一位顶级科学家张锋,将CRISPR-Cas9首次应用于哺乳动物,创办了包括Editas在内的7家公司,构建了从疾病治疗、诊断检测到农业在内的商业帝国。Editas主要拥有CRISPR-Cas9 和Cas12 的专利,用几种剪切酶亚型实现体外体内的基因治疗。同时,张峰联合同在 Bord实验室的刘如谦创立了BEAM公司,拥有单碱基编辑技术,主攻体内基因治疗。
鉴于基因治疗已成为划时代的医疗新技术,全球各大药企都提早布局,抢占技术制高点,欧美TOP10药企中的绝大多数已在该领域深耕多年。赛道中的代表性成员包括J&J、Merck、Lilly、Abbvie、AstraZeneca、Novartis,以及日本Takeda、中国的三生国健和恒瑞等药企。其中,拜耳、Vertex、再生元制药和Novartis是在基因编辑领域布局最多的MNC代表。如图6所示,以拜耳为例,在2023年与Mammoth的合作授权中,利用Mammoth公司的CRISPR系统合作开发体内基因编辑疗法,涉及5个预先选择的体内适应症,交易金额超过了10亿美金。
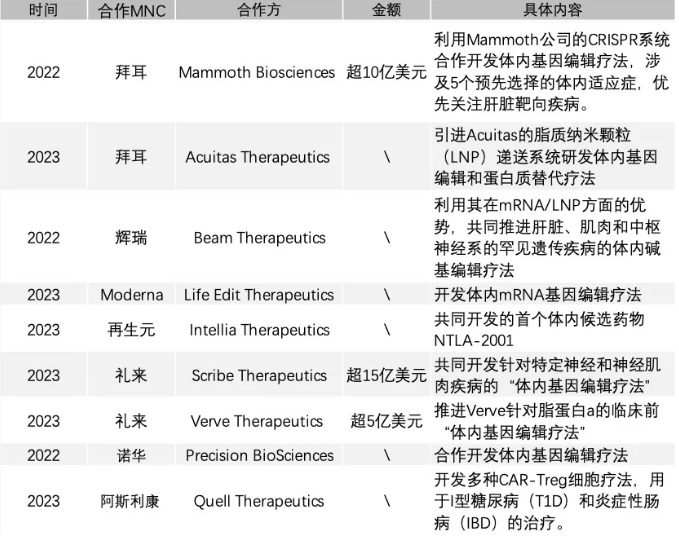
▲图6 2022年以来基因编辑相关大宗合作交易
据allied market research预测,未来10年(2024-2034年),基因治疗市场规模将以每年34.8%的年复合增长率稳定上升,预计2026年市场规模可达62.05亿美元。推动市场增长的因素包括全球研发持续投入、技术革新进步以及相关疾病的爆发增长。基因治疗领域技术更迭快速且频繁,市场增长迅速,值得资本市场长期关注,适时入场。