导读:
东方富海博士后创新实践基地秉承研究发现价值、研究引领投资的理念,对投资实务进行前瞻性研究。我们特别设立了“富海洞察”专栏,用于发布基地系列研究报告,供交流探讨。本文是基因改造病毒的相关研究,为基地出品的第十三篇报告。
在传统印象中,病毒一直是人类的强大敌人。但世界万物相生相克,相辅相成。人类也在通过不断的技术创新化敌为友,让病毒在越来越多的应用场景下,成为人类应对遗传病、恶性肿瘤、传染病及慢性病的有力助攻,例如用于治疗遗传病的AAV基因疗法、治疗恶性肿瘤的溶瘤病毒、防治传染病的病毒载体疫苗及治疗耐药菌感染的噬菌体等。本文将展开介绍这四种典型基因改造病毒疗法的应用场景及投资价值。
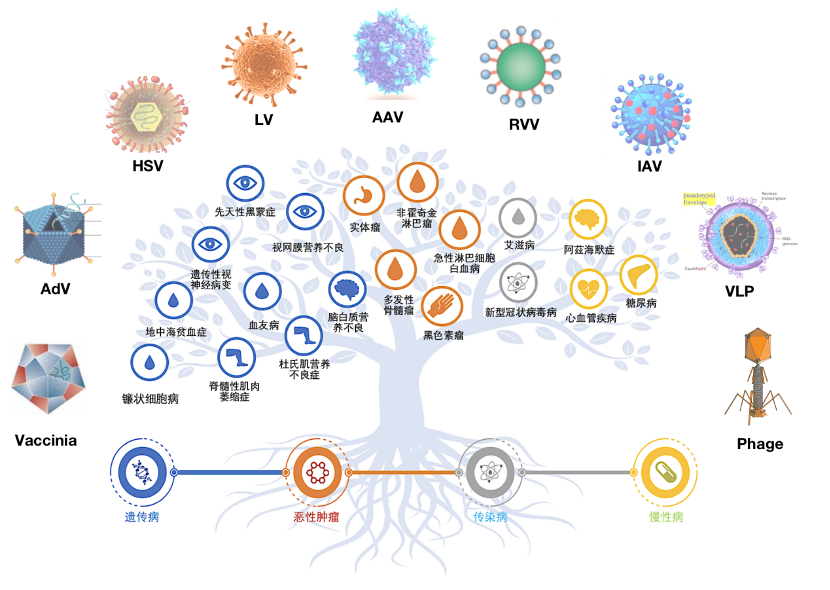
1AAV基因疗法
目前,基因疗法中最常用的病毒载体是腺相关病毒(AAV)。AAV最早于1965年从实验室腺病毒(AdV)中发现,具有无致病性、高效长期表达、易于基因操作及免疫反应低的特点,因此成为了基因递送的重要工具。1995年,AAV载体首次用于治疗人类的囊性纤维化病。2008年,科研人员在治疗菜伯氏先天性黑蒙症时利用了基于AAV载体的基因疗法,获得了良好的成果。2012年,第一个基于AAV用于治疗脂蛋白脂酶缺乏症LPLD的基因治疗药物Glybera获得了欧洲药品管理局EMA的批准。2017年,罗氏/Spark治疗由RPE65基因突变导致的遗传性视网膜疾病的AAV基因治疗产品Luxturna获得美国食品药品管理局FDA的批准。
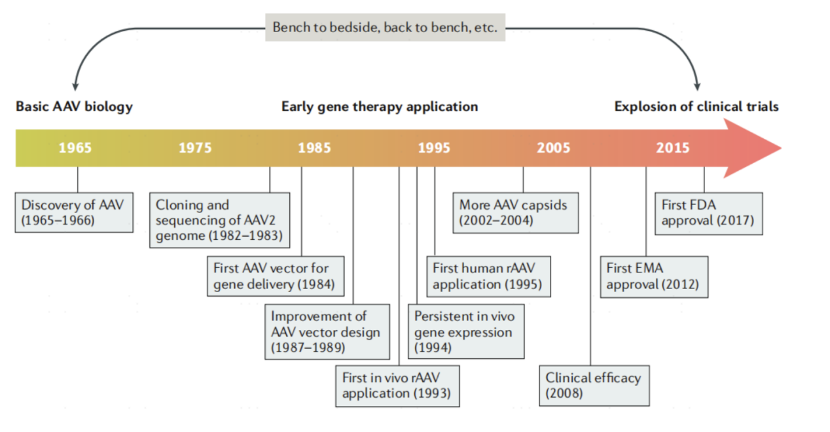
▲资料来源:Nat Rev Drug Discov.
自2017年FDA批准的Luxturna上市以来,AAV基因疗法已成为目前生物医药领域最炙手可热的细分赛道之一,目前全球已上市的AAV基因疗法有7款,近期更是实现了多个临床适应症的零突破。2023年6月22日,Sarepta Therapeutics与罗氏联合开发的基因疗法Elevidys(SRP-9001)获美国FDA加速批准上市,成为首个用于治疗杜氏肌营养不良的基因疗法。据悉,该药物定价为320万美元,是史上第二贵的基因治疗产品。其搭载的DNA包含一个截短型抗肌萎缩蛋白基因,该基因受MHCK7 启动子/增强子的控制,能够优先在心肌和骨骼肌中的表达。病毒血清型为恒河猴 74 型 (rAAVrh74) ,预期可以降低患者对载体具有预存抗体的可能性。2023年6月29日,Biomarin的A型血友病基因疗法ROCTAVIAN获美国FDA批准,这款产品基于有效性和安全性考虑选择了 AAV5 载体递送 FVIII 基因,已于2022年8月获得欧盟批准上市(全球首款A型血友病基因疗法),Biomarin为其制定的价格为290万美元。
虽然从上市产品和在研管线等维度来看,我国的AAV基因疗法均相较于海外其他国家起步晚,但2021年以来,国内AAV基因疗法取得了快速的发展,迎来了爆发期。目前,国内共22款AAV基因治疗药物IND申报获批,其中3款进入临床III期,这也意味着中国的AAV基因疗法离商业化的距离越来越近。
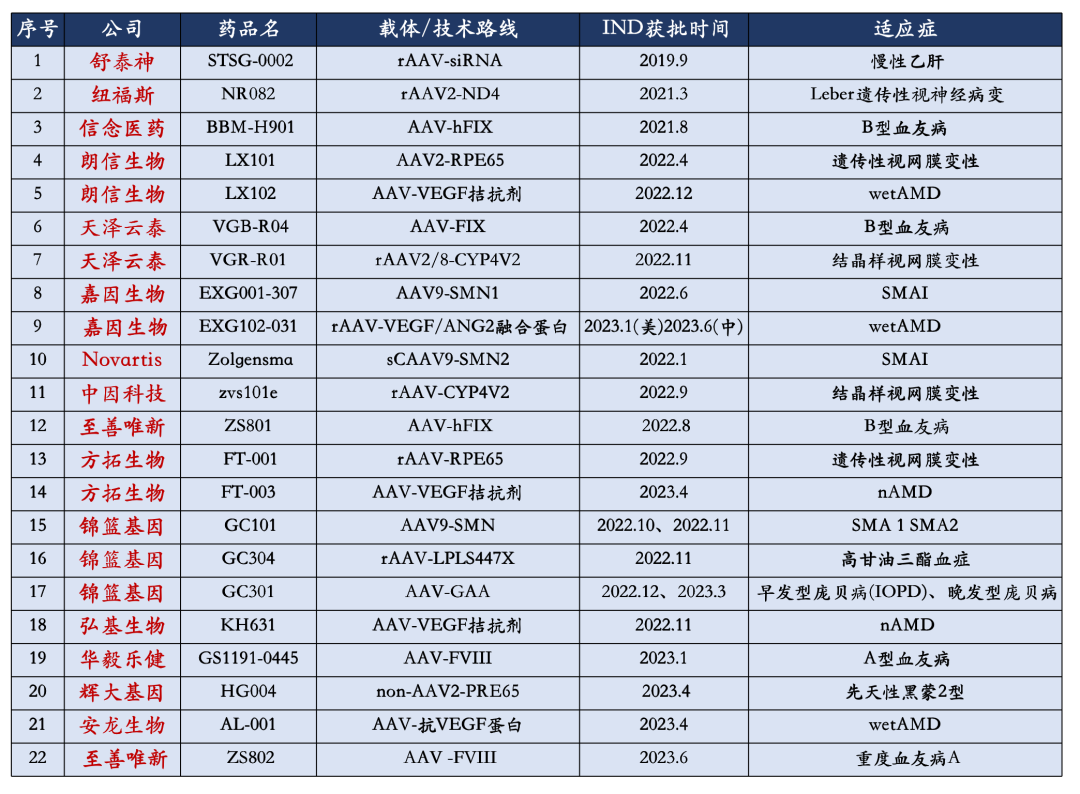
▲资料来源:CDE、FDA IND获批数据整理
AAV基因疗法针对的适应症虽趋于多样化,但目前仍主要扎推在眼科疾病及肝脏系统疾病两大热门领域。肝脏是较早被用于基因治疗的器官,而眼部则属于免疫豁免区域,是环境封闭的小组织靶点,并且患者所需剂量较低,是基因治疗最理想的靶器官之一。在CNS、心血管、肌肉、代谢类等疾病领域,AAV基因疗法仍存在巨大的临床空白。
由于不同AAV分型具有不同组织富集效应,科学家也在研究通过AAV载体实现靶向治疗。不同血清型的AAV对不同组织细胞侵染效率不同,表现出很强的靶向性。目前共分离出13种具不同组织嗜性的常见AAV血清型,其中多种血清型已经运用到多种疾病的治疗方法探索中。
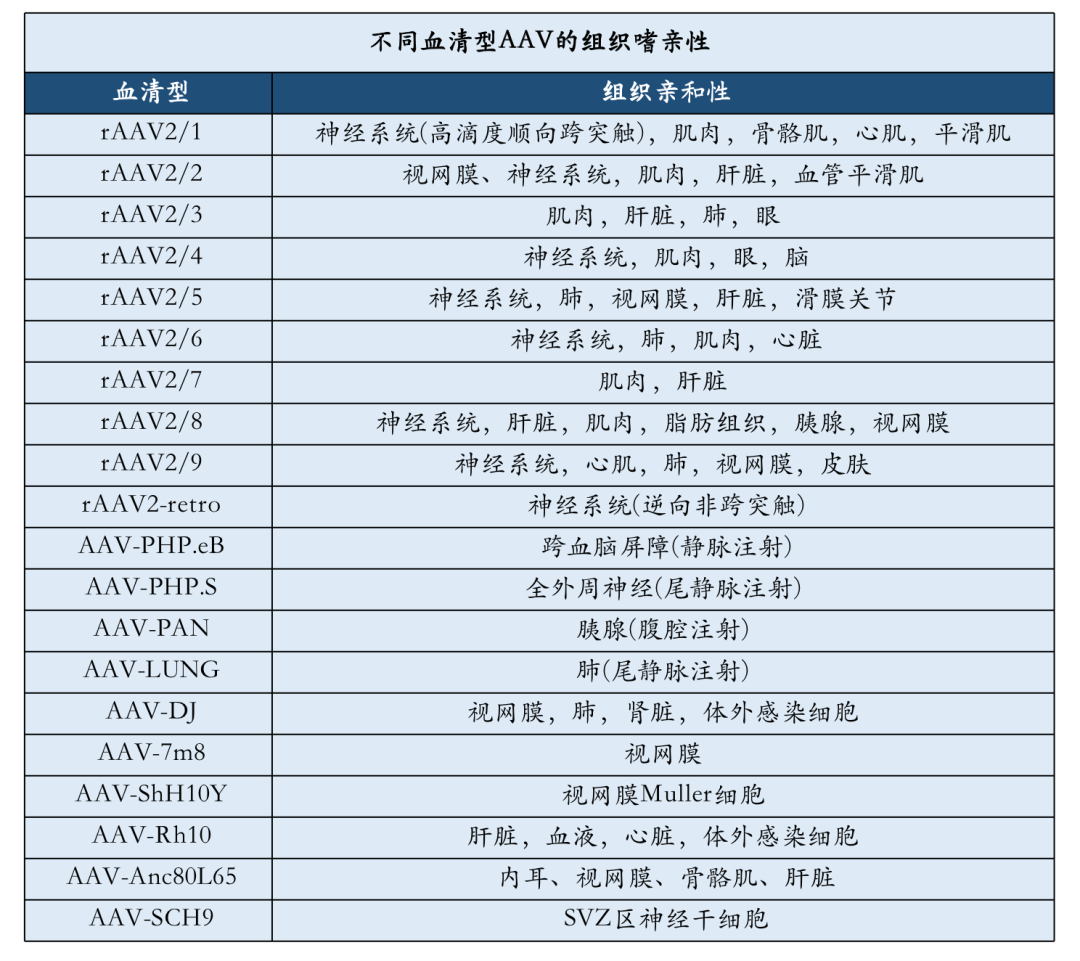
▲资料来源:和元生物整理
AAV衣壳由蛋白质组成,AAV衣壳组成是影响病毒感染活性和基因转导的关键因素。目前,已上市的AAV疗法以及进入临床的在研管线,大多数采用的还是天然血清型,这也是此前适应症出现“扎堆”现象的主要因素之一。据ClinicalTrail.gov统计,截至目前,进入临床阶段的AAV相关试验已达到了334项,集中在血友病、帕金森病、阿尔兹海默症、无脉络膜症、杜氏肌营养不良、先天性黑蒙及Leber遗传性视神经病变这七大适应症。但其中有些推进不太顺利,一大原因就在于天然的AAV血清型在非肝组织中的靶向性与感染效率低下。要想拓展AAV基因疗法的适应症,提高AAV药物的靶向性,寻找新型的AAV衣壳是关键的突破口。
未来,AAV基因疗法的创新发展方向主要集中在以下三方面:载体设计、工艺优化及临床设计。载体设计方面,除了新的血清型及设计新衣壳之外,能够严格控制基因的表达AAV安全开关设计也可以有效提升安全性。此外,构建组织特异性启动子也能够减少AAV转导的非特异感染,提升靶向治疗的精准度。面对AAV基因疗法的激烈竞争,国内企业也都在不断摸索各自的差异化疗法,例如更好的靶向性、更好的活性、更小的用药剂量,及更广的适应症等。
2溶瘤病毒
溶瘤病毒是一类针对性感染肿瘤细胞,同时激活患者的先天免疫系统和适应性免疫系统,最终特异性杀死肿瘤细胞的一类病毒。1904年,溶瘤病毒首次被发现有清除血液瘤的作用,《柳叶刀》报道一位患有慢性白血病的妇女,无意间感染流感病毒后,白血病症状意外好转,自此开创了病毒治疗肿瘤的先河。1996年,首个基因编辑的溶瘤病毒进入临床试验。21世纪是基因编辑病毒的快速发展期,目前全球研究最多的五类溶瘤病毒包括腺病毒、牛痘病毒、单纯疱疹病毒、呼肠孤病毒及柯萨基病毒,以下是它们所对应的临床研究概况。
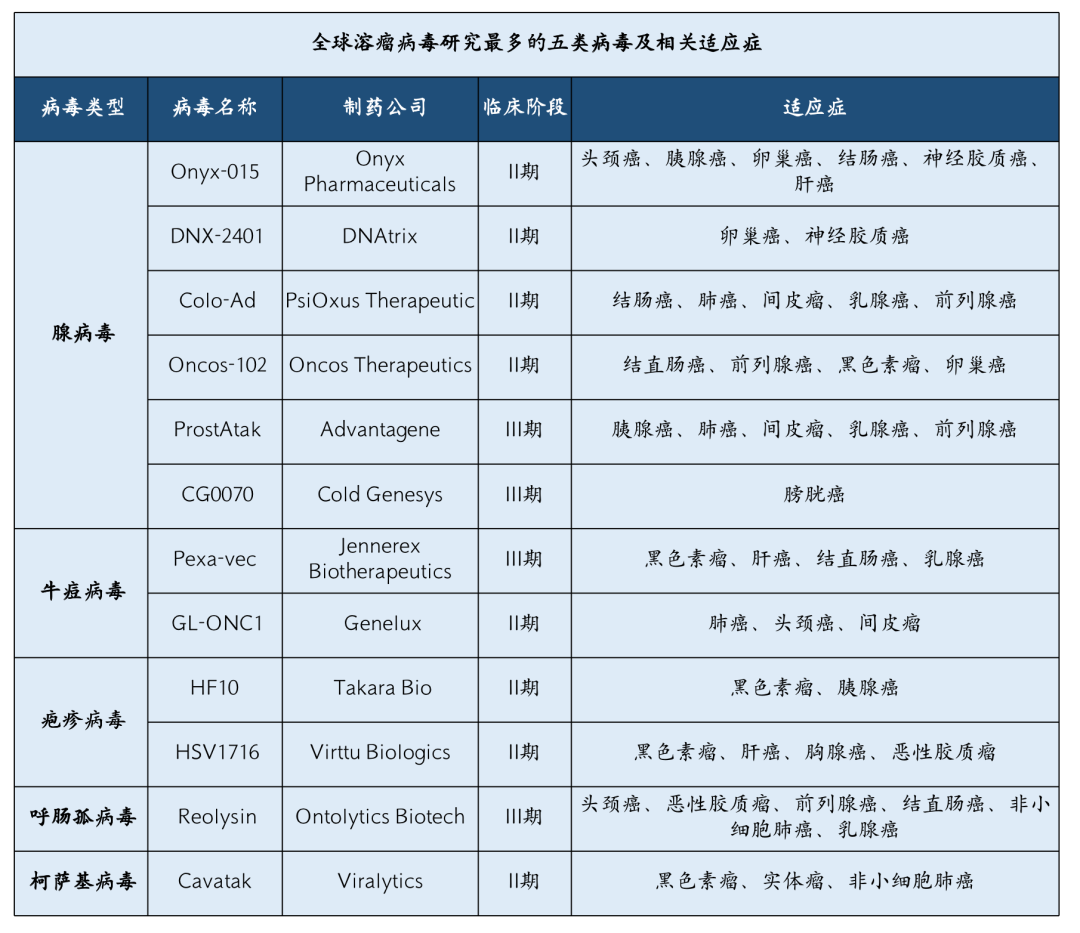
▲资料来源:观研天下数据中心整理
溶瘤病毒可通过直接杀死肿瘤细胞并引起机体的免疫反应发挥作用,但单纯的溶瘤病毒有一定的局限性,需将各种不同的病毒作为载体,通过基因修饰的方法增强或减弱病毒毒力并导入新的功能性基因,以提高其溶瘤作用。目前,临床试验中使用的溶瘤病毒大多经过了基因修饰。为了获得更好的抗肿瘤效果,基因修饰主要通过提高溶瘤病毒对肿瘤细胞的靶向性和增强机体的免疫反应来进行。
溶瘤病毒疗法治疗肿瘤的原理包括四个方面:(1) 肿瘤细胞裂解:瘤内注射或者静脉注射的溶瘤病毒感染肿瘤细胞并在其中繁殖;(2)T细胞致敏:成熟的树突状细胞体表展示抗原并激活区域内和远处T细胞;(3)先天免疫反应:被溶瘤病毒感染激活的辅助T细胞激活B细胞可以表达针对肿瘤细胞的中和性抗体,M1巨噬细胞和NK细胞可以通过对中和性抗体的识别对肿瘤细胞进行杀灭,改善肿瘤内免疫抑制环境;(4)适应性免疫反应:被激活的细胞毒性T细胞通过抗原识别,靶向杀灭肿瘤细胞。
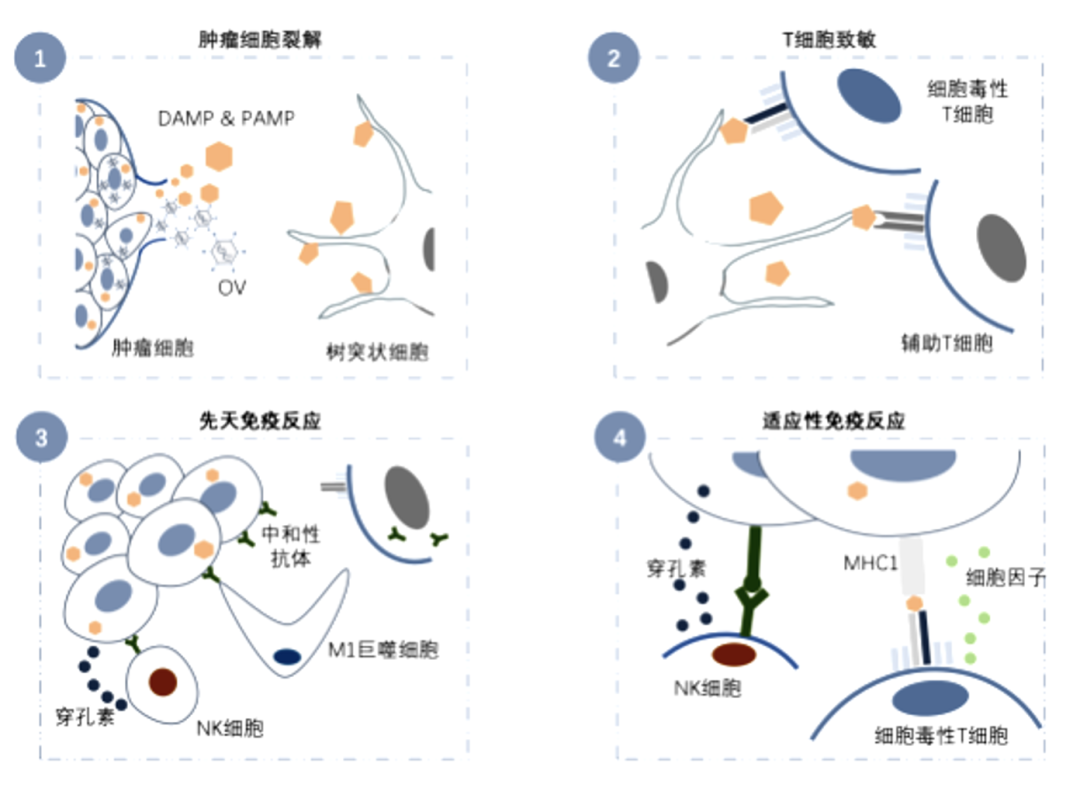
▲资料来源:沙利文报告
第一个复制选择性腺病毒ONYX-015于2005年在中国被批准用于治疗头颈部肿瘤。2021年获批用于治疗神经胶质瘤的第一三共Delytact是一款基于I型单纯疱疹病毒(HSV-1)开发的第三代溶瘤病毒产品,在保持G207基因组原有安全性的同时,在第二代HSV-1的G207基因组中引入额外的缺失突变,来增强抗肿瘤效果。Delytact治疗恶性脑胶质瘤的1年生存率高达92.3%,是常规治疗的6倍。研究还发现,Delytact在神经胶质瘤、乳腺癌、前列腺癌、鼻咽癌、结直肠癌等中均有效。

▲资料来源:《溶瘤病毒的免疫学机制及临床研究进展》
目前全球已有近200款溶瘤病毒产品在研。近年来, BMS、强生、默沙东等大型药企都已通过收购或合作的方式布局溶瘤病毒领域。国内布局溶瘤病毒的公司已超60家,主要企业包括亦诺微、滨会生物、复诺健、康万达等等,基本是在2010年后涌现的。中天士力、阿诺医药、恒瑞医药、乐普生物等公司通过授权引进的方式,引进了不同种类的溶瘤病毒产品。而三维生物、亦诺微医药、复诺健生物、滨会生物、天达康基因、达博生物等,则采取自主研发的方式入局溶瘤病毒领域。
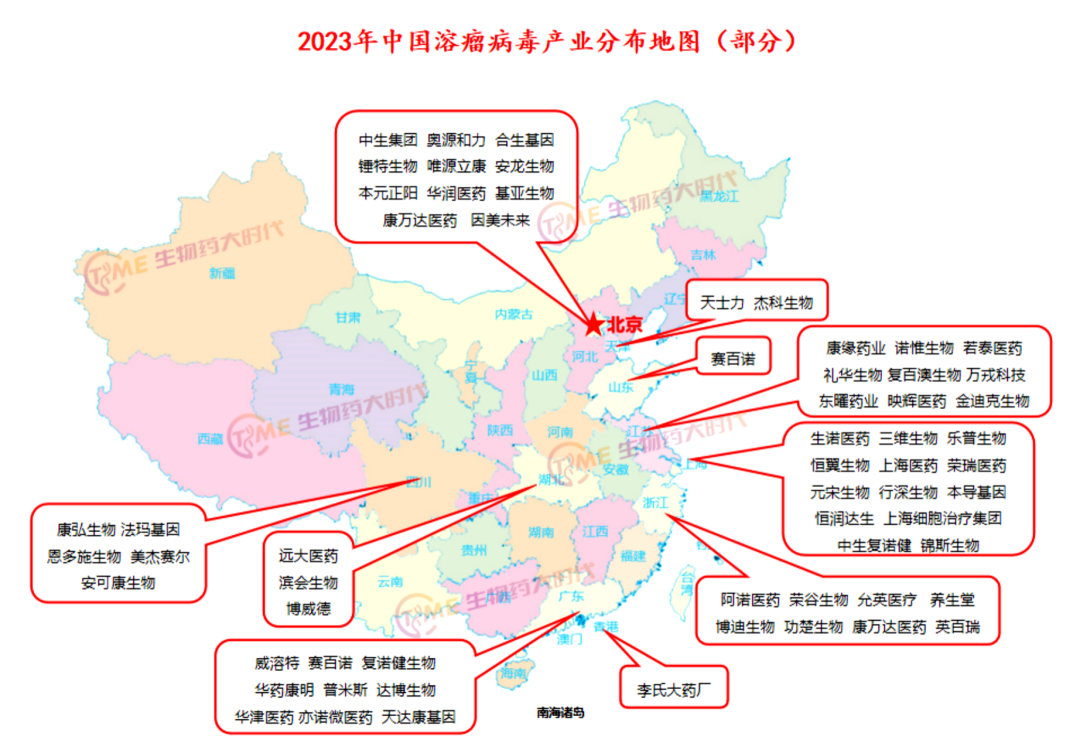
▲资料来源:生物药大时代整理
近期在2023年美国临床肿瘤学会(ASCO)年会上,多项溶瘤病毒研究公布了新进展。亦诺微可表达IL-12和PD-1的重组HSV-1溶瘤病毒产品T3011的I/II期的研究结果表明,T3011 IT单用及与Pembrolizumab的联合疗法都可耐受,其安全性和临床依从性较好,并可能会改变肿瘤微环境从而克服免疫抵抗力。复诺健表达IL-12和IL-15/RA有效载荷的非减毒HSV-1溶瘤病毒产品VG2025的I期试验的初步结果显示了其在晚期实体瘤患者中的有效性和可接受的安全性。
由于溶瘤病毒复杂的生物学机制,探索之路稍显漫长,已上市的溶瘤病毒产品还存在一些挑战亟待解决。例如注射后如何躲避免疫系统的攻击,肿瘤细胞溶解后如何及时清除体内残留的病毒。溶瘤病毒疗法的生物安全性还需进一步研究,基因重组的溶瘤病毒是否存在基因重排、基因突变;病毒是否会引起细胞因子风暴等。通过改造溶瘤病毒进行溶瘤病毒单一疗法的疗效仍有上升空间。
未来溶瘤病毒的发展趋势是与化疗、免疫检查点抑制剂以及CAR-T疗法联用,给实体瘤患者带来更多临床的获益。其次,对免疫调节机制的研发将带动溶瘤病毒的开发进展,进一步拓展其潜力。随着溶瘤病毒疗法的安全性和有效性提升,其将在肿瘤治疗中占据越来越重要的位置,为更多的肿瘤患者带来治愈希望。
3病毒载体疫苗
病毒载体疫苗的主要应用于新发传染病和传统疫苗仍无法有效预防的传染病,包括艾滋病毒/艾滋病、丙型肝炎、疟疾、肺结核、呼吸道合胞病毒 、巨细胞病毒等。病毒载体通常分为两大类,复制缺陷型和复制完整型。感染并进行病毒复制或通过转导将遗传物质引入宿主细胞,产生免疫反应。
自80年代首次发表了病毒载体疫苗的概念验证后,已经开发了多种用于动物的病毒载体疫苗,但尚未在人类疫苗中广泛普及,部分原因是更高的监管标准及安全性要求。目前,已有少数几种病毒载体疫苗被至少一个国家或地区的监管机构批准使用,包括针对埃博拉病毒的疫苗rVSV-ZEBOV和Zabdeno/Mvabea,前者是迄今为止唯一获得批准的具有复制能力的病毒载体疫苗。新冠疫情大流行推动了病毒载体疫苗的开发,目前已有5种针对新冠病毒的病毒载体疫苗获批使用,包括Oxford-AstraZeneca、Janssen的疫苗、Sputnik V、康希诺的Convidecia及万泰生物的喷鼻流感病毒载体新冠疫苗。
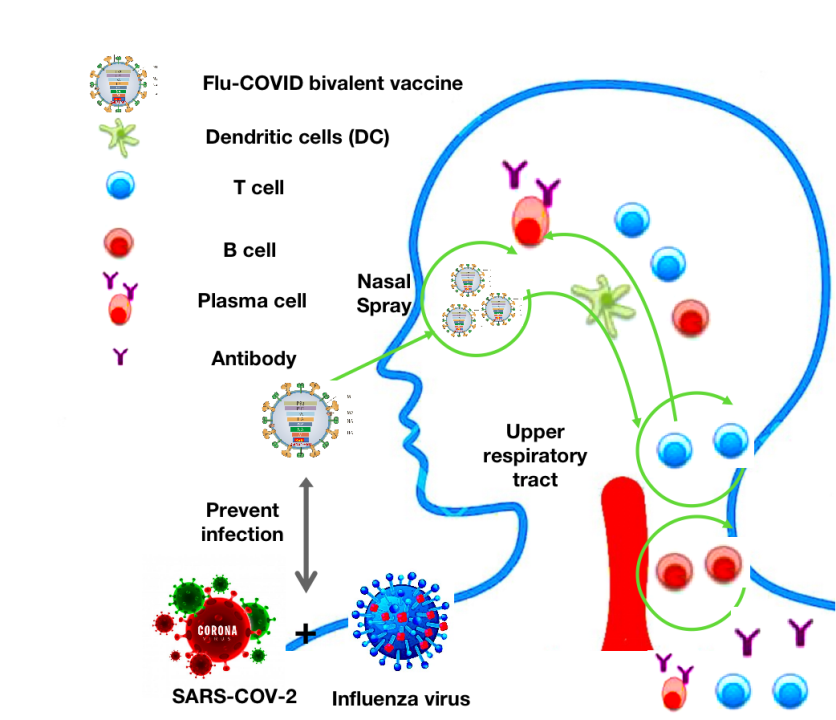
▲资料来源:https://go.nature.com/40e9WZ1
除了常见的肌肉注射诱导全身免疫的免疫途径,病毒载体疫苗也可以通过鼻腔、口服、皮内和气雾剂接种。经口或鼻吸入的疫苗可以诱导出呼吸道黏膜特有的分泌型IgA抗体,以弥补肌肉注射接种后中和抗体和IgG在口鼻咽喉部位分布水平低的情况,从而使人体可以将病毒阻隔在其入侵部位。这些替代免疫途径可以在粘膜部位诱导免疫反应,以预防或限制呼吸道或胃肠道感染。通过诱导机体产生高水平的中和抗体、T细胞反应和粘膜免疫,比其他肌注型疫苗具有更好的保护作用。病毒载体在控制呼吸道病毒性传染病方面具有广泛的应用前景,未来还可以进一步开发利用以提高病毒载体疫苗的反应原性、疗效和载体剂量。
4噬菌体
近年来,全球耐药性细菌感染流行率上升,已成为潜在的公共卫生危机,迫切需要有效的“后抗生素时代”应对策略。一个有希望的替代方案就是噬菌体。噬菌体疗法于2014年被美国国家过敏与传染病研究所(NIAID)列为应对细菌抗生素耐药性的重要武器之一。迄今为止,国内外噬菌体药物研发公司获得的资金已接近90亿人民币。2021年11月BioNTech以1.5亿欧元收购奥地利噬菌体公司Phagomed,也让噬菌体疗法重新走到了聚光灯之下。这不仅是噬菌体药物开发领域的一笔大规模收购,也是大型药企对噬菌体技术的认可。
我国的噬菌体疗法起源于1958年,在中国瑞金医院开展的第一例噬菌体疗法。上海噬菌体所自2017年成立以来,救治了超过百位来自全国各地的病患。他们大部分都被超级细菌感染、抗生素治疗无效、长期住院甚至危及生命,又在接受噬菌体疗法后回归正常生活。近年来,深圳也开展了数例多重耐药患者的噬菌体治疗。2022年1月,深圳三院和深圳先进技术研究院合作,开展了噬菌体鸡尾酒疗法,救治了一位身患吸入性肺炎并同时感染3种超级细菌的老人。IIT临床数据表明,联用多种噬菌体可以扩展抗菌谱,并减少细菌的噬菌体抗性。
噬菌体是一种只感染细菌而不感染其他生物的病毒。因此,理论上,噬菌体对人类无害,而对它们的目标细菌来说,却是致命的,它们可以感染并杀死目标细菌,然后再感染相邻的同种细菌。噬菌体疗法相较于抗生素具有以下优势:
1) 噬菌体具有高度特异性:不会破坏微生物菌群。能够降低感染艰难梭菜和万古霉素耐药肠球菌的风险;不受限于细菌抗生素耐药性的活性,能够为多种耐药菌感染提供急需的治疗;
2) 对宿主不会产生与化学结构相关的毒性,不是对现有化学结构的增量改变,而是一个全新治疗类别;
3) 可以通过合成生物学进行改造,增加额外功能:生物膜降解,旁观者杀伤效应,组织定位等。
噬菌体的活性物质:感染末期是噬菌体达到杀菌作用的关键环节,此时它可以通过裂解酶将宿主细菌裂解。内溶素可以特异性地作用于细菌细胞壁,是目前应用和研究最多的噬菌体裂解酶之一。天然噬菌体裂解酶具有高度的宿主特异性和强烈的裂解活性,能破坏细菌生物被膜,而且具备绿色安全、不易产生耐药等优势。同时,噬菌体裂解酶具有模块化结构特点,运用蛋白质工程技术将其重组,可增强其裂解活性、提高稳定性以及靶向性,这使其在成为新型抗菌药物方面拥有广阔的前景,而且做为大分子蛋白,法规监管路径也很清晰。噬菌体裂解酶技术治疗的优势显而易见。裂解酶在体外与细菌接触的瞬间迅速破裂细菌细胞,可使细菌浊度迅速下降。更重要的是,裂解酶的结合结构域针对宿主细胞壁受体分子,经演化后能够特异性识别细菌并杀死细菌,使细菌很难对其产生耐受性。
噬菌体基因改造:为了大规模推动噬菌体的临床应用,一系列的噬菌体基因工程技术被开发出来,包括用于天然噬菌体基因组的改造,利用同源重组进行噬菌体基因组的改造,将同源重组与CRISPR/Cas结合进行噬菌体基因组的改造及人工噬菌体基因组的合成、组装和重启进行噬菌体基因组的改造。

▲各类噬菌体基因改造技术
噬菌体展示技术:1985年美国Missouri大学Smith博士首先提出噬菌体展示技术,利用丝状噬菌体在体外表达外源基因,可以把外源肽或蛋白质显露在噬菌体表面,并使表达产物保持良好的空间构象,由此可提供了可用亲和免疫纯化法筛选表达特异肽或蛋白质的噬菌体。通过测定插入噬菌体的DNA序列,即可明确所表达的外源物质的氨基酸序列,目前已广泛应用于抗原抗体、抗原决定簇的定位、蛋白质相互作用位点的确定、酶与底物、受体与配体等分子识别的相关领域及酶抑制剂、诊断技术、细胞因子、特异调节分子的分离和人工抗体和疫苗的制备、多肽药物的研制等诸多领域。噬菌体展示技术是生物创新医药研发的源头技术,其在新的抗体和多肽的发现和优化过程中有着核心的作用,并能够和传统抗体发现平台有效对接,用于抗体,抗体偶联药物和CAR-T/TCR-T等领域。
据不完全统计在抗体研发阶段采用噬菌体展示技术的上市抗体10个。受限于噬菌体展示技术的专利限制,该技术在一段时间内只掌握在少数公司手中,自从第一个利用噬菌体展示技术的抗体阿达木于2002年上市的后十年少有利用该技术的抗体上市。近几年专利将到期,由于噬菌体展示技术在抗体发现和优化中的相当明显的效率优势,利用噬菌体展示技术的上市抗体将会越来越多。
总结来说,目前噬菌体疗法应用领域包括医疗、农业和养殖三个方向,抗生素耐药和全球感染多重耐药菌凸显了噬菌体的重要性。目前, 关于噬菌体应用研究范围很广, 涉及各种类型的体外感染控制模型和多种感染性疾病。不仅针对人类疾病的预防与治疗, 而且涉及到食品及饲料中病原细菌的清除、细菌生物膜的防控。近年来噬菌体治疗研究开始得到各个国家政策的支持和鼓励, 但噬菌体疗法仍处于早期技术发展阶段,技术应用尚不成熟,治疗成本相对偏高,监管机制不够完善。然而,市场展现了对于噬菌体疗法的迫切需求,社会环境的各项因素以及技术的快速迭代,可以预见噬菌体及噬菌体衍生品的未来可期。
5结语
2020年以来,国家药监局与药物评审中心对病毒载体及其相关的基因治疗、细胞治疗行业密集发布多份行业法规,推动病毒载体生产行业快速走向规范化发展。病毒载体及其相关的细胞基因治疗等产业在“十三五”、“十四五”计划中均受到重点鼓励,并在发改委、知识产权局等多个政府部门的发展规划中被列为重点鼓励产业。本文重点介绍了AAV基因疗法、溶瘤病毒疗法、病毒载体疫苗及噬菌体疗法这四种基因改造病毒在遗传病、恶性肿瘤、传染病及慢性病等疾病领域的临床应用价值,未来该行业的发展趋势主要集中在以下三点:
1) 现有病毒载体的优化和升级:提高现有病毒载体的转导效率、靶向特异性、安全性、目的基因的稳定表达和包装容量,同时降低免疫原性;
2) 新型病毒载体的开发:如无细胞毒性、目的基因释放速度可控、持续表达及具备靶向特异性的新型病毒载体;
3) 商业化生产工艺的突破:如开发新的病毒包装体系、提升细胞培养密度、降低空壳率等。“稳定转染+悬浮培养”工艺或将成为未来主流趋势。